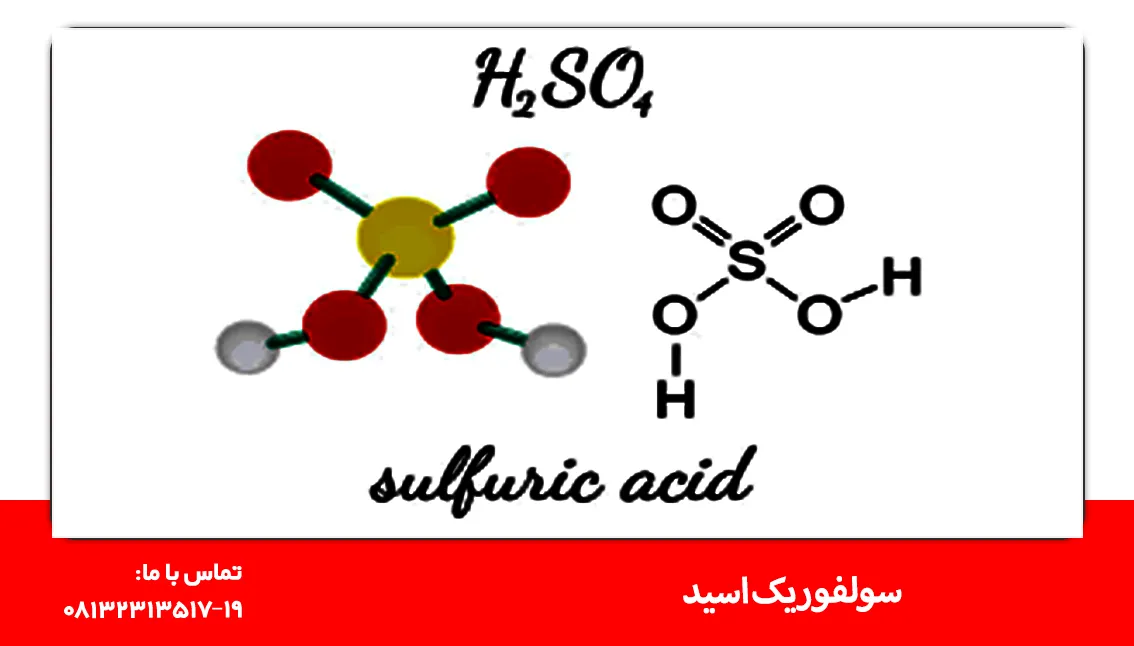
شاید شما هم مثل برخی از دیگر کاربران، در ذهن خود با سؤال سولفوریک اسید چیست؟ دست و پنجه نرم میکنید. ما در این مقاله از سایت آراسنگ الوند، برای شما به بررسی پاسخ این پرسش و دیگر نکات مهم دربارۀ این ماده معدنی میپردازیم. سولفوریک اسید یا اسید سولفوریک که در قدیم با نام «جوهر گوگرد» شناخته میشده است، اسیدی معدنی و بسیار قوی است که با هر نوع درصدی در آب حل میشود. فرمول سولفوریک اسید H2SO4 است. این ماده دارای مولکولهای قطبی است که پیوند هیدروژنی دارند؛ از این رو این ماده از نوع مایع ویسکوز با نقطه جوش بالا مانند سیلیس به شمار میرود.
واکنش اسید سولفوریک با آب بسیار گرمازا بوده و این ماده به راحتی در آن حل میشود. این مادۀ بیرنگ، بی بو و با گرانروی بالا در مقداری زیادی در جهان تولید میشود که آن را به عنوان سلطان مواد شیمیایی میدانند و سرانۀ تولید آن تأثیر زیادی در شاخص تعیین پیشرفت کشور دارد.
سولفوریک اسید چیست؟
h2so4 یک خورندۀ قوی است که بخش زیادی از بارانهای اسیدی را تشکیل میدهد و قطرات باران با آلایندههای موجود در هوا واکنش داده و تولید اسید میکند. این ماده تا حدودی خطرناک است و با فلزات نیز واکنش میدهد و هر چه دمای آن بالاتر رود مقدار این واکنش بیشتر میشود، ولی روی جیوه و سرب تأثیری ندارد. اسید سولفوریک به نام اسید ماتلینگ یا روغن ویتریول نیز شناخته میشود. ماهیت اسیدی قوی داشته و خورنده است. در غلظتهای بالاتر، به عنوان یک عامل اکسیدکننده و عامل خشککننده عمل میکند. این مایع شربتی است که بی بو و بدون رنگ بوده و محلول در آب است و با حل شدن در آب گرما آزاد میکند. از سولفوریک اسید به طور گستردهای در تولید کود و همچنین در سنتز شیمیایی و فرآیندهای فاضلاب استفاده میشود.
سولفوریک اسید به نقل از ویکی پدیا:
اسید سولفوریک که در گذشته جوهر گوگرد خوانده میشد، نوعی اسید معدنی است که از عناصر گوگرد، اکسیژن و هیدروژن تشکیل میشود و فرمول شیمیایی آن H2SO4 است. این ماده یک مایع بیرنگ، بیبو، و با گرانروی بالا است که در آب انحلالپذیر بوده و واکنش ترکیب شدن آن با آب بسیار گرمازا است.
تاریخچه اسید سولفوریک
در ابتدا سولفوریک اسید توسط زکریای رازی کشف شده و او از طریق تقطیر کانیهای سولفات آهن و مس سولفات این اسید را ایجاد کرده است.
مشخصات فیزیکی اسید سولفوریک
- سولفوریک اسید مایعی شفاف، بیرنگ و روغنی است.
- نقطه ذوب: 10.35 درجه سانتیگراد
- نقطه جوش: 315-338 درجه سانتیگراد
- چگالی بخار: 3.4
- وزن مخصوص: 1.84
مشخصات شیمیایی سولفوریک اسید
اسید سولفوریک بسیار واکنشپذیر و خورنده بوده و در آب و الکل اتیلیک محلول است. واکنش قوی آن ممکن است مواد آلی (کاغذ سبک یا سایر مواد قابل احتراق) را در صورت مخلوط شدن با یکدیگر مشتعل کند.
کاربردهای سولفوریک اسید چیست؟
این ماده با داشتن ویژگیهای شیمیایی و فیزیکی فراوان در صنایع گوناگون قابل استفاده است. از عمدهترین مصارف آن که حدود 60 درصد آن را تشکیل میدهد، تولید کودهای شیمیایی است. در ادامه شما را با کاربردهای این مادۀ پرمصرف در صنایع گوناگون آشنا میکنیم.
کود سولفوریک اسید
از این ماده برای تولید کود آمونیوم سولفات استفاده شده و موجب جبران گوگرد در خاک میشود. در زمان استفاده، این نوع کود با آهکهای موجود در خاک واکنش میدهد و موجب تولید سولفات کلسیم آبدار میشود، که به آن گچ کشاورزی میگویند. از این واکنش همچنین سولفات منیزیم به وجود میآید.
استفاده از سولفوریک اسید در کشاورزی، همچنین موجب نفوذپذیری آب و هوا در خاک رس میشود. خاک رس در زمان آبیاری آب کمی را جذب کرده و حتی ممکن است بعد از چند روز آبیاری هنوز آب به ریشۀ آن نرسیده باشد. استفاده از اسید سولفوریک در این خاک موجب جلوگیری از آسیب به ریشۀ گیاه میشود. همچنین این ماده در ریشۀ درخت پسته تأثیر زیادی دارد و کشاورزان دیگر به دلیل نامرغوب بودن خاک دچار ضرر نمیشوند. البته لازم به ذکر است که کشاورزان نباید بیش از حد از آن استفاده کنند.
کاربرد اسید سولفوریک در شوینده
sulfuric acid دارای توانایی بالای هیدرولیز قوی بوده و قادر است که چربیها و لیپیدها را به راحتی حل کند. از این رو از آن به عنوان حلال چربیها و لیپیدها در شویندهها استفاده میکنند.
پالایش نفت با سولفوریک اسید
در زمان پالایش نفت دو نوع تصفیه شیمیایی و تصفیه با هیدروژن صورت میگیرد که پالایش با این ماده از نوع تصفیه شیمیایی است. از اسید سولفوریک در تبدیل ترکیبات اتیلنی به استرهای محلول در اسید استفاده میکنند و برای تصفیه فرآوردههای سفید مانند بنزین و نفت سفید فابل استفاده هستند. هدف از استفاده آن، خنثی کردن ترکیبات بازی، حذف ترکیبات اکسیژندار و اکسیده کردن مرکاپتانها به دی سولفیدهای کمضرر است.
تصفیه آب با اسید سولفوریک
h2so4 مانند سیلیس در تصفیه آب نیز مؤثر است. آبهای ورودی به دستگاه شیرین کن RO دارای PH خنثی و یا به میزانی اسیدی است؛ به دلیل این که موجب افزایش حلالیت یونهای فلزی در سطح ممبرینها و در نهایت کاهش میزان گرفتگی ممبرینها میشود. یک واحد تزریق اسید داریم که موجب تنظیم PH میشود. تزریق سولفوریک اسید موجب کاهش PH آب شده و از آن برای شستوشوی ممبرینهای دستگاههای تصفیه آب RO یا CIP استفاده میکنند.
اسید سولفوریک در تولید مواد شیمیایی
استفاده از سولفوریک اسید در تولید مواد شیمیایی شامل ساخت کاپرولاکتام برای الیاف نایلون و دی اکسید تیتانیوم است که یک رنگدانۀ سفید روشن است. علاوهبراین، اسید سولفوریک (h2so4) برای تولید اسید هیدروفلوئوریک که جایگزین کلروفلوئوروکربنها (CFCs) شده است برای استفاده در یخچالها یا سیستمهای هوا ضروری است.
اسید سولفوریک به عنوان بهترین حلال در صنایع
نمکهای سولفاتی مانند سولفات کلسیم (گچ) و سولفات هیدروژن از مشتقات این اسید خاص هستند. اگرچه سولفیتهای فلزی معمولاً به راحتی در آب حل نمیشوند، سایر نمکهای سولفات کاملاً برعکس بوده و همین موضوع اسید سولفوریک را به یکی از دردسترسترین و بهترین حلالها برای استفاده در طیف گستردهای از صنایع تبدیل میکند.
مکملهای معدنی در بخش سلامت و سدیم لورت سولفات در شامپو و لوازم بهداشتی نمونههای دیگری از نمکهای سولفات هستند. این ذرات هستند که به باران اسیدی کمک میکنند، اما در عین حال، ممکن است نقش محافظتی جزئی به عنوان ذرات معلق در هوا نسبت به انتشار تابش خورشید داشته باشند.
سولفوریک اسید (h2so4) برای تولید مواد منفجره
از اسید سولفوریک برای ساختن مواد منفجره نیز استفاده میشود. افزودن اسید نیتریک و سولفوریک اسید به سلولز باعث ایجاد نیتروسلولز بسیار قابل اشتعال میشود. به همین دلیل، خرید اسید سولفوریک در مقادیر زیاد نیاز به مجوز دارد. اسید سولفوریک گرید تجاری با حداقل غلظت 95 درصد به فروش میرسد.
اسید سولفوریک در آزمایشگاه
در آزمایشگاه، سولفوریک اسید به عنوان عامل خشککننده و در تجزیه و تحلیل کمی که غلظت محلول با استفاده از روشی به نام تیتراسیون محاسبه میشود، استفاده میشود. هر گاه آب به اسید اضافه شود، یونهای هیدروژن با بار مثبت از اسید از طریق اهدای پروتون آزاد میشوند. بازها یا قلیاها مانند هیدروکسید سدیم در مجاورت آب به دلیل پذیرش پروتون یونهای هیدروکسید با بار منفی تولید میکنند.
بسته به مقدار اسید یا قلیا در یک محلول، میتوان غلظت آن را با افزودن نقطه مقابل آن محاسبه کرد و فهمید که چه زمانی بارهای منفی و مثبت یکدیگر را خنثی کرده و به هم میپیوندند و مولکول آب را تشکیل میدهند. مثلاً هنگامی که اسید سولفوریک (h2so4) و هیدروکسید سدیم (NaOH) مخلوط میشوند، باهم واکنش داده و مولکولهای آب را تشکیل میدهند.
اسید سولفوریک در صنعت موتور
اسید سولفوریک یک الکترولیت است. الکترولیت محلولی است که در آن یونها وجود دارد. باتریهای سرب اسیدی در خودروها از مجموعهای از صفحات اکسید سرب با شارژ مثبت غوطهور در الکترولیت و صفحات سرب خالص با شارژ منفی که به طور مشابه غوطهور شدهاند، تشکیل میشوند. این الکترولیت اسید سولفوریک رقیق شده (تقریباً 33٪) و به همین دلیل است که سولفوریک اسید اغلب به عنوان اسید باتری شناخته میشود .
باتریهای خودرو انرژی شیمیایی را ذخیره کرده و از طریق واکنش هیدروژن، اکسیژن، سرب و گوگرد با یکدیگر، آن را به انرژی الکتریکی تبدیل میکنند. وجود آب مقطر (خالص) در اسید سولفوریک هیدروژن و سولفات تولید میکند. الکترونهای منفی آزادشده از صفحۀ منفی به صفحۀ مثبت میروند، در حالی که یونهای سولفات جایگزین این اتلاف در صفحه با بار منفی (الکترود) میشوند و متعاقباً با سرب واکنش داده و سولفات سرب را تشکیل میدهند. اسید سولفوریک برای این واکنش عالی است، زیرا یک اسید دی پروتیک است که میتواند دو پروتون خود را به طور همزمان آزاد کند.
اسید سولفوریک در صنایع غذایی
سولفوریک اسید اغلب در صنایع غذایی برای کمآبی کردن برخی از خوراکیها مانند میوهها یا توقف رشد باکتریها و سایر میکروبهای مضر که فرآیند پوسیدگی را تسریع میکنند، استفاده میشود. از آن به صورت اسپری برای نگهداری گوشت یا مرغ استفاده میشود. اسید سولفوریک (h2so4) نیز یک افزودنی غذایی همهمنظوره است که در نوشیدنیهای الکلی و پنیر مورد استفاده قرار میگیرد.
برای خشک کردن میوهها، توانایی اسید سولفوریک در حذف آب بسیار مورد توجه است. هنگامی که در حضور آب، سولفوریک اسید واکنش نشان میدهد H 3 O + (هیدرونیوم) و HSO 4 – (سولفات هیدروژن) تشکیل میشوند. واکنش بعدی هیدروژن سولفات را با آب ترکیب میکند تا H 3 O + و SO 4 2- یا سولفات بیشتری تولید کند. اسید سولفوریک به سرعت pH هر بافتی را که با آن تماس پیدا میکند کاهش میدهد.
با این حال، در فرآیندهای خشک کردن میوه، اسید سولفوریک و h2so4 غلیظ در تماس مستقیم با میوه نیست، بلکه برای خشک کردن هوای اطراف آن، حذف رطوبت و در نتیجه کمک و تسریع فرآیند کمآبی استفاده میشود.
از دیگر کاربرد سولفوریک اسید میتوان به موارد زیر اشاره کرد:
- رنگ نقاشی؛
- استخراج فلزات؛
- تولید انواع حشرهکش؛
- صنایع کاغذسازی، روزنامه، مقوا و تولید دستمال کاغذی؛
- فرایندهای نیتروژندار کردن؛
- تولید دترجنتها؛
- تولید اسید هیدروفلوریک ؛
- ساخت چسب؛
- تولید فنل؛
- تولید ضد یخ؛
- تولید پروپانول.
خطرات اسید سولفوریک چیست؟
به دلیل این که این ماده یک نوع اسید قوی است در زمان استفاده از آن باید تمامی نکات ایمنی را رعایت کرد. در صورت تماس سولفوریک اسید با بدن میتواند موجب تحریکات شدید پوستی و سوختگی و آسیب به چشمها میشود. این نوع تماس ممکن است موجب ضایعات چشمی و حتی نابینایی شود. استنشاق این ماده نیز موجب بروز سرفه، تحریک ریهها و تنگی نفس میشود.
در ضمن این ماده اسیدی بسیار خطرناک است و با آب واکنش داده و در نتیجه موجب گرمازایی زیادی میشود. اگر شما قصد رقیقسازی این ماده را دارید به هیچ وجه آن را با آب مخلوط نکنید، زیرا در واکنش اسید سولفوریک با آب، موجب پاشش و جوشش اسید میشود. برای رقیقسازی آن را کم کم به آب اضافه کنید.
اهمیت سولفوریک اسید در اقتصاد
سولفوریک اسید (H2SO4) یکی از مهمترین و پرکاربردترین ترکیبات شیمیایی است و در اقتصاد جهانی نقش مهمی ایفا میکند. این اسید قابلیتهای ویژهای دارد که برای بسیاری از صنایع و فرآوردهها ضروری است. در زیر به برخی از اهمیتهای سولفوریک اسید در اقتصاد اشاره خواهم کرد:
- صنایع شیمیایی: سولفوریک اسید به عنوان یک اسید قوی و محلولکننده استفاده میشود. در بسیاری از فرآوردهها و فرایندهای صنایع شیمیایی، از سولفوریک اسید به عنوان کاتالیزور، ماده فعال، تنظیمکننده pH و محلولکننده استفاده میشود. این برای تولید کودها، پلاستیکها، رنگها، صابونها، لاستیک، محصولات شیمیایی و تمامی صنایع شیمیایی ضروری است.
- صنایع معدنی: سولفوریک اسید در فرآوری مواد معدنی ازجمله مس، روی، نقره و سرب استفاده میشود. این اسید به عنوان محلولکننده مواد آلی و غیرآلی در فرآیندهای استخراج و جداسازی مواد معدنی مورد استفاده قرار میگیرد.
- صنعت آب و فاضلاب: سولفوریک اسید در صنعت آب و فاضلاب به عنوان ماده تنظیمکننده pH و بازیابی فلزات از پسابهای صنعتی استفاده میشود. این اسید قادر است تا فلزات سنگین موجود در پسابها را جذب کند و با استفاده از فرآیندهای شیمیایی مناسب، فلزات مورد نیاز را به طور بازیابیشده استخراج کند.
- تولید برق: سولفوریک اسید در صنعت تولید برق به عنوان ماده الکترولیتی در باتریها استفاده میشود. باتریهای سولفوریک اسیدی از مهمترین منابع تأمین انرژی در برقهای اضطراری، خودروها، سیستمهای نورپردازی و دستگاههای الکترونیکی است.
- صنعت نساجی و رنگرزی: سولفوریک اسید در فرآیندهای رنگرزی و پرداخت پارچهها استفاده میشود. این اسید قادر است به خوبی کیفیت رنگرزی را افزایش دهد و در تثبیت رنگها و جلوگیری از ریزش رنگها نیز نقش دارد.
- صنعت الکترونیک: سولفوریک اسید در تولید اجزای الکترونیکی مانند مدارهای چاپی (PCB) استفاده میشود. این اسید در فرایند حکاکی و تمیزکاری PCBها استفاده میشود و برای حفظ کیفیت و عملکرد صحیح اجزا الکترونیکی بسیار حیاتی است.
- صنعت نفت و گاز: سولفوریک اسید در صنایع نفت و گاز به عنوان ماده شستوشو و تمیزکاری استفاده میشود. این اسید قادر است تا رسوبات و آلودگیهای موجود در لولهها و تجهیزات نفتی را از بین ببرد و به تمیزی و عملکرد بهتر آنها کمک کند.
به طور کلی، سولفوریک اسید به عنوان یک ماده شیمیایی بسیار چندمنظوره و کلیدی در بسیاری از صنایع و فرآوردهها استفاده میشود. اهمیت آن در اقتصاد به دلیل تأثیر بزرگی که بر بسیاری از صنایع و فرآوردهها دارد، بسیار بالاست.
فرایند تولید سولفوریک اسید
H2SO4 یکی از مهمترین مواد شیمیایی صنعتی است که با استفاده از فرآیند مجاورت تولید میشود.
در گام اول گوگرد در مجاورت اکسیژن، اکسید و ترکیب میشود و گوگرد دی اکسید به دست میآید.
S(s) + O2(g) → SO2(g)
در گام بعدی گوگرد دی اکسید در مجاورت یک کاتالیزگر با اکسیژن اضافه، به گوگرد تری اکسید، اکسید میشود.
SO2(g) + O2(g) → SO3(g)
در گام بعدی با واکنش گوگرد تری اکسید با آب، محلول سولفوریک اسید تشکیل میشود.
SO3(g) + H2O(l) → H2SO4(aq)
با انجام مجدد مراحل بالا و فوت کردن گوگرد تری اکسید درون محلول اسید سولفوریک، پیروسولفوریک اسید (H2S2O7) به دست میآید.
فروش اسید سولفوریک صنعتی، خوراکی و کشاورزی
قیمت سولفوریک اسید متناسب با قیمت جهانی گوگرد است. جدای از این عامل، موارد دیگری مانند قیمت جهانی سوخت، بازار مصرف و نوع بسته بندی آن در قیمت این ماده تأثیرگذار است. sulfuric acid در گریدهای صنعتی در سه نوع مختلف تولید میشود:
| ردیف | درصد خلوص سولفوریک اسید خوراکی |
| 1 | 98% |
| 2 | 50% |
| 3 | 35% |
اسید سولفوریک خوراکی چیست؟
در بسیار از نقاط جهان مانند اروپ، تولیدکنندگان مواد غذایی از محلولهای رقیق سولفوریک اسید خوراکی استفاده میکنند. این ماده به عنوان کنترلکننده PH و نگهدارنده با هدف جلوگیری از رشد باکتری و میکروبهای مضر استفاده میشود.
نتیجهگیری
حال این سؤال پیش میآید که اسید سولفوریک 98 درصد یعنی چه؟ این نوع دارای پایداری زیادی است، از این رو فروش بهتری نسبت به بقیه انواع آن دارد. شما در این مطلب از سایت آرا سنگ الوند با خطرات، کاربرد سولفوریک اسید و شباهت آن با سیلیس، آشنا شدید و همچنین پاسخ پرسش سولفوریک اسید چیست؟ را دریافتید. همچنین اگر شما قصد دارید تا با فرمول سولفوریک اسید (h2so4) آشنا شوید و دربارۀ این ماده معدنی بیشتر بدانید، این مقاله را با دقت مطالعه نمایید.
سوالات متداول
سولفوریک اسید چیست؟
اسیدی معدنی و بسیار قوی است که با هر نوع درصدی در آب حل میشود و فرمول شیمیایی آن H2SO4 است. این ماده دارای مولکولهای قطبی هست که پیوند هیدروژنی دارند.
کاربرد h2so4 را نام ببرید؟
کودهای شیمیایی
کاربرد اسید سولفوریک در شوینده
پالایش نفت
تصفیه آب















نظر خود را بنویسید